【概要】
試験管を用いて、より実験的に時計反応を実施した。
動画(※都留文科大学化学実験Ⅰの一部)
時計に見立てた『時計反応』
・準備物
100ml三角フラスコ、可溶性デンプン 0.2g、純水、200ml三角フラスコ 3個、亜硫酸水素ナトリウム(NaHSO₃) 2.08g、ホールピペット(1~5ml用を各2本で計10本)、試験管 10本、ヨウ素酸カリウム(KIO₃) 1.72g、ガラス棒、温度計
・操作手順(A液とB液の作成を手が空いた時間に効率よく進めること)
【A液(亜硫酸水素ナトリウム+デンプン)の調整】
- 100ml三角フラスコに可溶性デンプン0.2gと純粋50mlを入れる。その後、70℃程度に加熱してデンプンを良く溶かした後、室温まで放冷しておく。→放冷中にB液の作成へ

- 200ml三角フラスコに亜硫酸水素ナトリウム2.08g(0.02㏖)を入れる。さらに純水を加えて溶解させ、全量を50mlにする。
- デンプン水溶液を亜硫酸水素ナトリウムの三角フラスコに移す。→これをA液とする。
【B液(ヨウ素酸カリウム)の調整】
- 200ml三角フラスコにヨウ素酸カリウム1.72g(0.08㏖)を入れる。さらに純水を加えながらガラス棒を用いて溶解させ、全量を100mlにする。→これをB液とする。B液作成後、A液作成(2.)に戻る。
【A、B液作成終了後の操作】
- ホールピペット(1~5ml用)を用いて、A液を試験管にそれぞれ1~5mlとる。使用したホールピペットはA液入り三角フラスコに差し込んでおく。→再度実験を行う際に使いまわせるため。
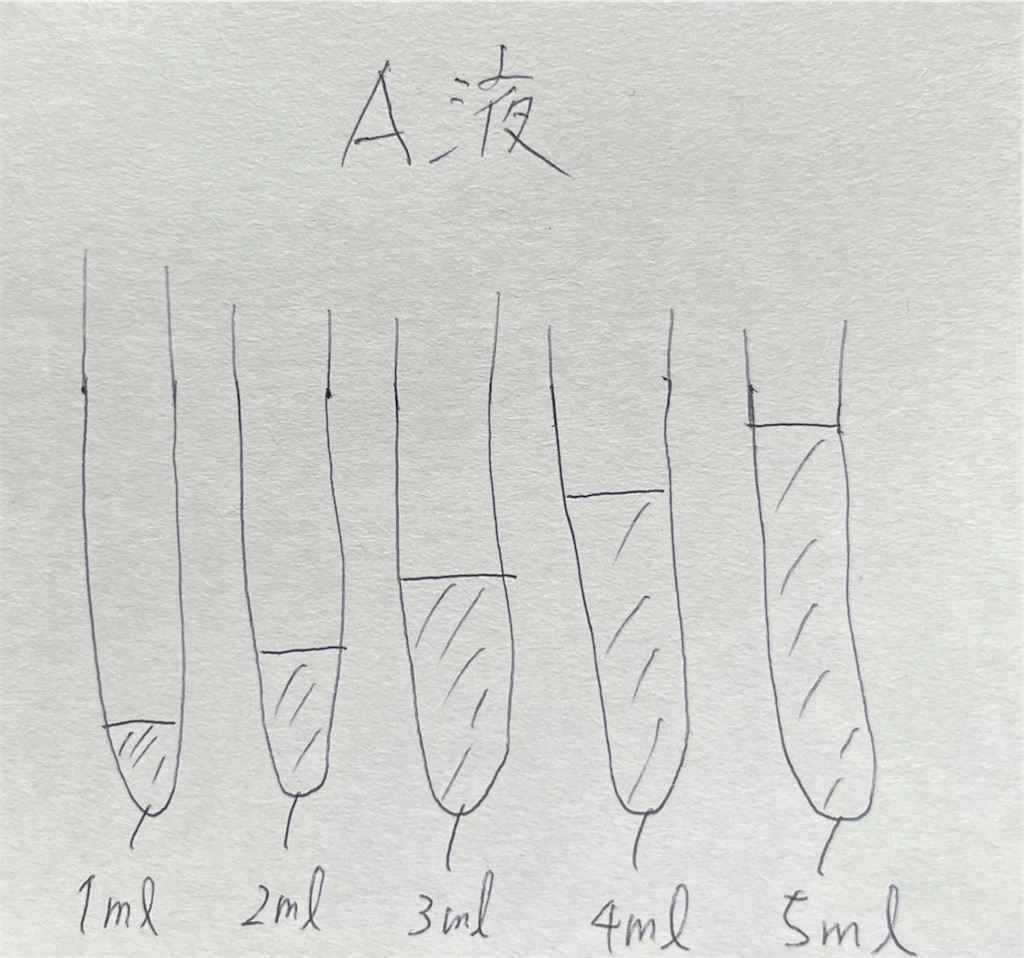
- 200ml三角フラスコに純水100mlを入れる。そこに新しいホールピペット(1~4ml用)を差し込んでおく。そのホールピペットを用いてA液入り試験管に純水を加えて全量を5mlにする。加え方は下図参照。
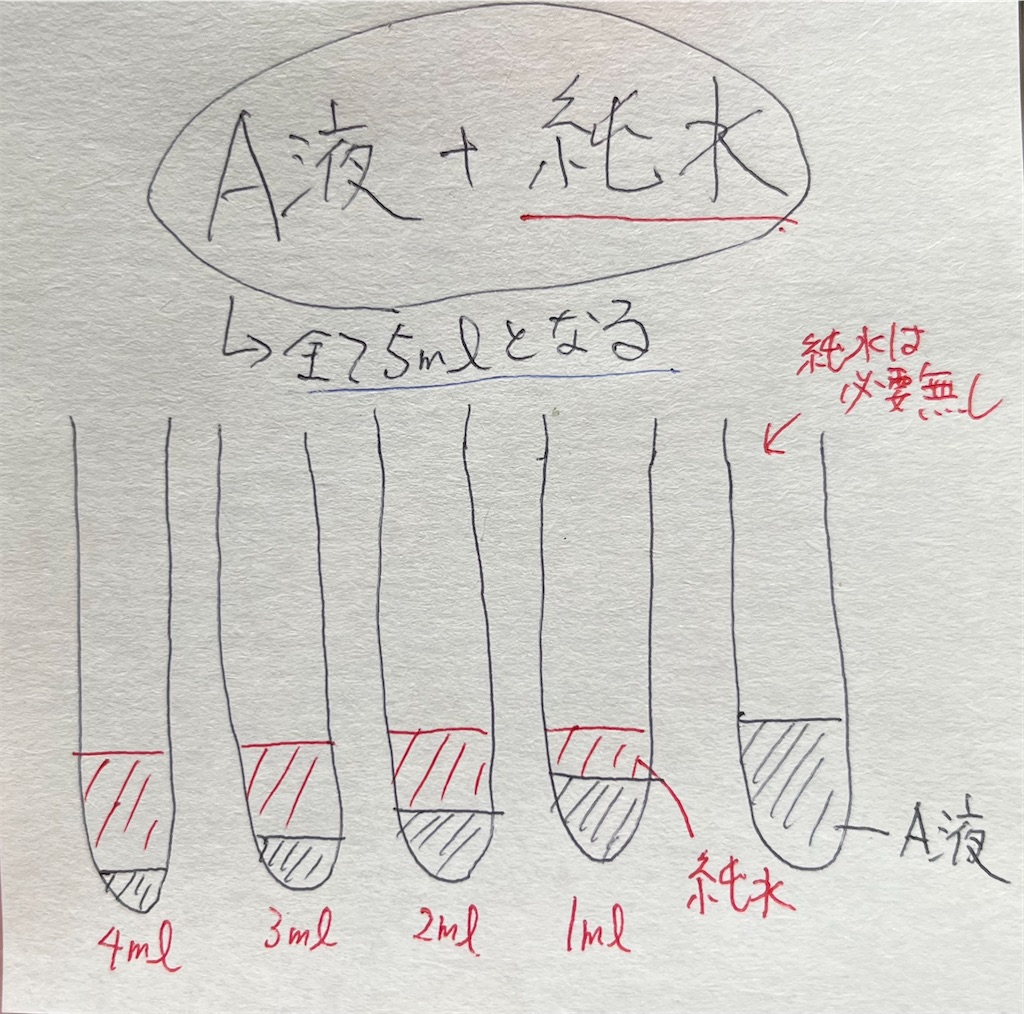

- 新たな試験管に、ホールピペット(5ml用)を用いてB液を量り入れる。B液入り試験管(5ml)を5本作成する。
- A液+純水入り試験管1本に対して、B液入り試験管1本を加える。また、入れたと同時に時間を計測し、色が変化した時間を記録していく。
- 1~4の操作を繰り返し、複数回のデータを記録する。その際、ホールピペットを使いまわすと効率的。
・留意点
- 水道水に含まれる塩素が反応を阻害することがあるので、純水をなるべく使用すること。
- ホールピペットの扱いに注意する。持ち運ぶ際は縦に持ち、指で抑える時は人差し指で行う。また、吸いすぎによる溶液の吸い込みに注意。

- A液は長期間の保存には向かない。亜硫酸ナトリウムが酸化してしまうので作り置きせず、実験時に調整することが望ましい。
- デンプン溶液が、初めは濁っていたものの加熱して溶けた後冷めると透明になる様は観察しておきたい。ただ、加熱のし過ぎで焦げ付かないように注意。

・結果
濃度計算は、A液+B液もしくは、A液+B液+純水で、全体が10mlとして計算している。亜硫酸水素ナトリウム(NaHSO₃、M=104)、ヨウ素酸カリウム(KIO₃、M=214)
(例)aの濃度計算。先ずはA液を作った際のモル濃度を求める。
(2.08/104)×(50/1000)=0.40㏖/L
これを用いて、反応後の亜硫酸水素イオンを求める。
【0.40×(5/1000)】/(10/1000)=0.20
となる。以降は5/1000の5の部分が変わっていく。
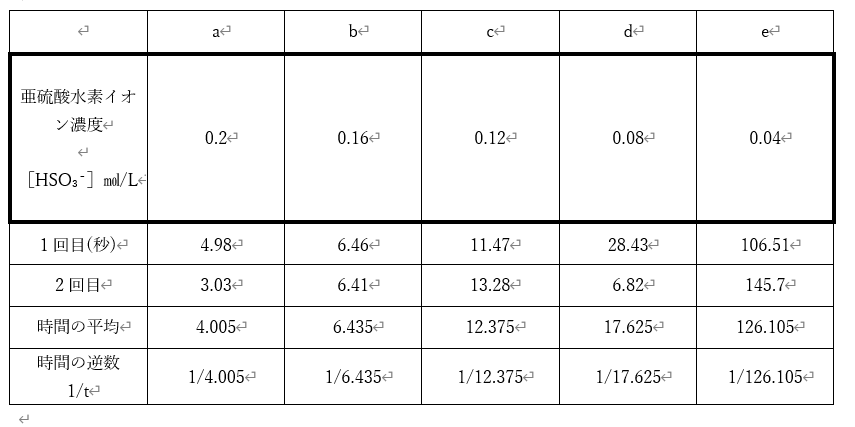
2回目ではcとdの反応速度が変化した。想定では1回目と同じ結果になるはずだか、濃度調整や加えた純水の量に差異が出た可能性がある。ただ、反応をよく見ると、完全に変色し終わるのはcの方が早い。変色の開始だけ見れば間違いと思われるが、変色の終了までを見ると予想通りとも言える。然し、操作にミスがあったとは思われる。【画像は2回目の変色の様子】

原理
ヨウ素酸カリウムと亜硫酸水素ナトリウムの反応式は次のとおり。
2KIO₃ + 5NaHSO₃ → 3NaHSO₄ + Na₂SO₄ + K₂SO₄ + I₂ + H₂O
ただし、酸化還元反応としては、次の3つの反応が同時に起こっている。
IO₃⁻ + 3HSO₃⁻ → I⁻ + 3SO₄²⁻ + 3H⁺・・・①
5I⁻ + IO₃⁻ + 6H⁺ → 3I₂ + 3H₂O・・・②
I₂ + HSO₃⁻ + H₂O → 2I⁻ + SO₄²⁻ + 3H⁺・・・③
特に、②で生成したヨウ素(I₂)が③で消費されていく。③でHSO₃⁻が低下していくと、ようやくヨウ素(I₂)の濃度が高まり、溶液中にデンプンとヨウ素デンプン反応が起こる。
時計反応についての更に詳しい解説はこちら→





監督官をしていただいている先生のブログ(らくらく理科教室)はこちら→らくらく理科教室 (sciyoji.site)
先生のYouTubeチャンネルはこちらから→らくらく科学実験 - YouTube
※都留文科大学理科教育の一環